胶质母细胞瘤(Glioblastoma, GBM)是最常见的颅内恶性肿瘤,患者中位生存时间仅为14-18个月。超过90%的GBM患者在接受治疗后会快速复发。研究表明,肿瘤进化是导致其治疗耐受和复发的主因之一。既往研究依托于GBM原/复发队列样本,在基因组水平解析肿瘤进展的关键分子变异事件,为理解GBM在不同治疗压力下的分子改变模式提供了重要参考。目前,有关GBM在治疗前演进的潜在分子机制尚不明确,尤其是肿瘤微环境在此过程中所扮演的角色仍有待进一步刻画。这主要由于缺少适合的研究模型和技术对其瘤内细胞演进过程开展系统深入的研究,导致有关原发GBM的治疗方案在近十几年的临床实践中仍没有重大突破。
2022年9月19日,国际顶尖肿瘤学期刊《癌症发现》(Cancer Discovery)在线发表南京医科大学工信院汪强虎教授团队、北京市神经外科研究所江涛教授团队与南京医科大学第一附属医院神经外科尤永平教授团队的合作论文,题为“胶质母细胞瘤免疫微环境协同肿瘤自然演进”(Natural coevolution of tumor and immunoenvironment in glioblastoma)。研究团队首次利用多发病灶模型揭示胶质母细胞瘤中肿瘤与微环境协同自然演进过程。

汪强虎教授团队、江涛团队和尤永平团队紧密合作,收集了珍贵的多病灶脑胶质瘤患者样本,并进行了单细胞转录组测序和全外显子测序等。研究发现同一患者的多个病灶在空间上相互隔离独自进化;团队开发了用于表征GBM自然演进特征(Natural Evolution Signature, NES)的计算方法;研究团队发现肿瘤组织中的缺氧事件是导致肿瘤快速演进的重要始动因素之一。缺氧诱导的肿瘤内部低氧诱导因子-1(HIF1A)激活能够进一步驱动下游活化因子蛋白1亚家族(FOSL2)上调膜联蛋白A1(ANXA1)表达,进而招募并驯化外周血来源巨噬细胞,最终形成免疫抑制的微环境。这些被驯化的巨噬细胞能够进一步协同促进肿瘤演进,并且通过分泌趋化因子(C-C基元)配体2(CCL2)等提高肿瘤侵袭能力。
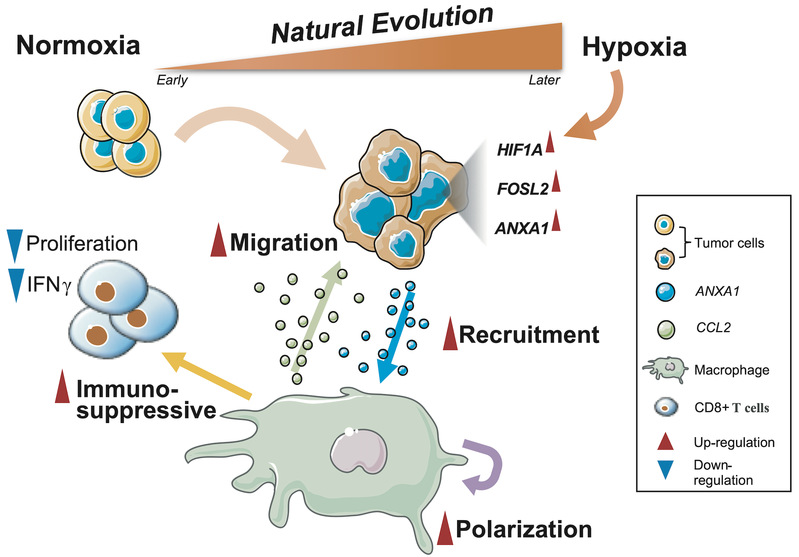
该研究为全面理解微环境协同肿瘤自然演进过程及分子机制提供了一种崭新的思路,也为抑制肿瘤进展及提高GBM免疫治疗效果提供新靶点和新方法。
原文链接:https://aacrjournals.org/cancerdiscovery/article/doi/10.1158/2159-8290.CD-22-0196/709256/Natural-coevolution-of-tumor-and-immunoenvironment
