男性乳腺癌(male breast cancer, MBC)约占所有乳腺癌的1%,发病率呈逐年上升趋势。大多数MBC患者是激素受体阳性,类似于晚发型、绝经后雌激素受体(ER)和孕激素受体(PR)阳性(ER+PR+)的女性乳腺癌(female breast cancer, FBC)。目前对MBC的了解有限,男性患者的临床管理和治疗策略主要参考同亚型的FBC患者。然而,由于其独特的临床特征和筛查、治疗的缺乏,MBC通常在确诊时即为晚期,与同亚型的女性患者相比更易发生远端转移及治疗抵抗,整体复发率更高,预后更差。据统计,MBC患者的死亡率比FBC患者高19%。这表明,MBC的治疗现状有待改善。越来越多的研究指出,由于性染色体、激素水平的不同,男性和女性癌症患者在能量代谢模式和免疫反应等方面存在差异。目前,MBC和FBC间的细胞状态和免疫特征差异尚不清楚,迫切需要了解MBC发展的潜在机制以改善其治疗现状。
近期,南京医科大学丁强/汪强虎团队在Nature Communications杂志发表了题为Single-cell transcriptome analysis indicates fatty acid metabolism-mediated metastasis and immunosuppression in male breast cancer的研究论文。该研究利用scRNA-seq和scTCR-seq技术探索乳腺癌的肿瘤微环境,并比较了激素受体阳性MBC和FBC样本之间的免疫和代谢特征。

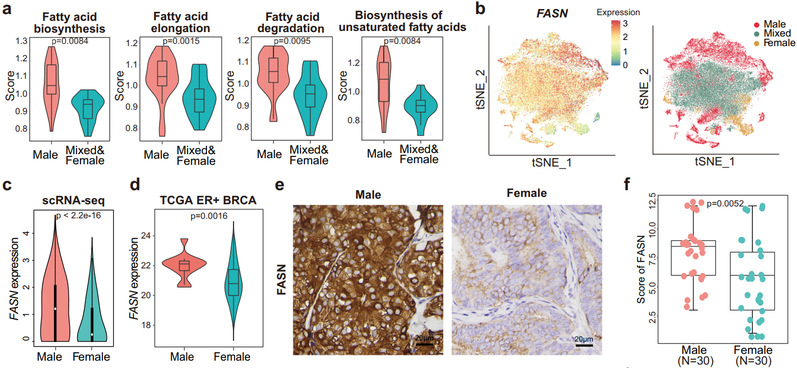
研究发现,MBC的T细胞浸润程度比FBC显著更低。MBC的肿瘤细胞具有更强的迁移、转移能力。由转录因子AR和SREBF1调控的脂肪酸代谢激活与MBC的肿瘤细胞转移和低免疫浸润有关。脂肪酸合酶FASN的表达水平在MBC肿瘤细胞中显著升高,并与MBC患者的不良预后相关。
MBC肿瘤微环境中的T细胞p38-MAPK和脂质氧化途径激活,呈衰老、耗竭和功能失调的状态。相比之下,来源于FBC肿瘤微环境的T细胞表现出更高的细胞毒性,以及IL2、IL4、IL5、TNF-alpha等细胞因子介导的免疫激活通路的活化。此外,研究还发现MBC肿瘤微环境中特异性富集细胞毒性低、脂肪酸代谢活化的KRT8+ T细胞。

本项研究表明脂肪酸代谢异常激活是MBC转移和免疫抑制的重要机制,为深入理解MBC的肿瘤免疫学特征和代谢模式提供了重要信息,并为开发针对MBC的治疗策略提供新方向。
南京医科大学生物信息学系博士后李科宁是本研究的共同通讯作者,南京医科大学博士生孙汉东、硕士生张立燊、连云港市第二人民医院王钟林、南京医科大学博士生顾丹灵为共同第一作者。
