传染性微生物与宿主细胞之间的斗争对人类的疾病或健康状况起决定作用。迄今,由于抗生素滥用和耐药病原体的增加,细菌感染仍然是全球健康的主要威胁。为了防止抗生素的不利影响,出现了诸如光热和磁热等热消融疗法的替代策略来抑制细菌感染,但热消融过程中靶部位周围产生的过多热量通常会破坏宿主细胞并延长愈合时间,导致无法正常愈合。近日,我院胡本慧教授与新加坡南洋理工大学陈晓东教授课题组深度合作,报道了一种基于TRIM(热干扰界面诱导缓解)效应的局部热管理策略,从而为热消融疗法增加了‘剪枝’功能:选择性杀灭细菌并最大程度地减少宿主细胞间内聚力损失,从而实现准确的抗菌治疗。相关成果于2月19日在线发表于《Advanced Materials》(影响因子25.809)。

TRIM敷料膜由热响应水凝胶区和机械支撑区按微尺度交替排列组成,表面的动态微形貌可在红外辐射下干扰细菌定植并提升灭菌效率。在热消融治疗中,该敷料膜可响应调节与附着皮肤的界面接触,局域限制产生的热量,将皮肤损伤的风险降至最低。力学生物学研究进一步表明,对于表面特征而言,具有关键尺寸的TRIM敷料膜在维持表皮细胞间内聚力方面起着至关重要的作用。在耐药菌感染的小鼠中进行的活体研究表明,具有 TRIM效应的热响应伤口敷膜可有效降低副作用、消除感染并促进伤口愈合。该研究实现了针对细菌感染的无抗生素治疗,并证明了临床敷料的转化潜力,对抗菌疗法的未来生物界面设计有启示作用。
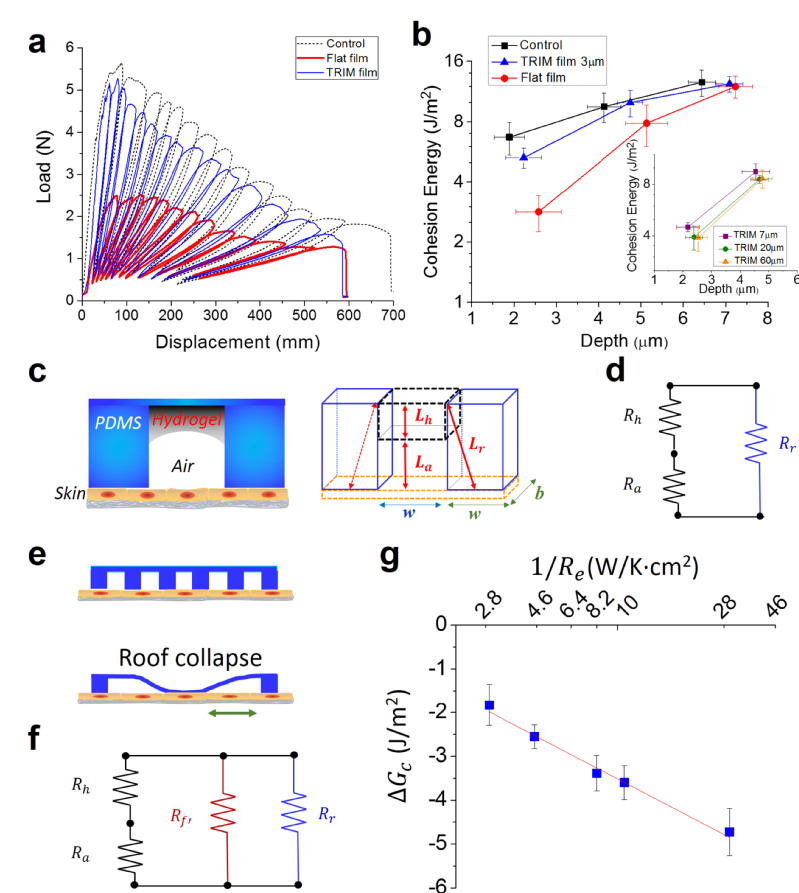
文中图4:生物力学表征验证TRIM效应:热响应微结构显著降低了光热治疗中表皮细胞间内聚力的损失
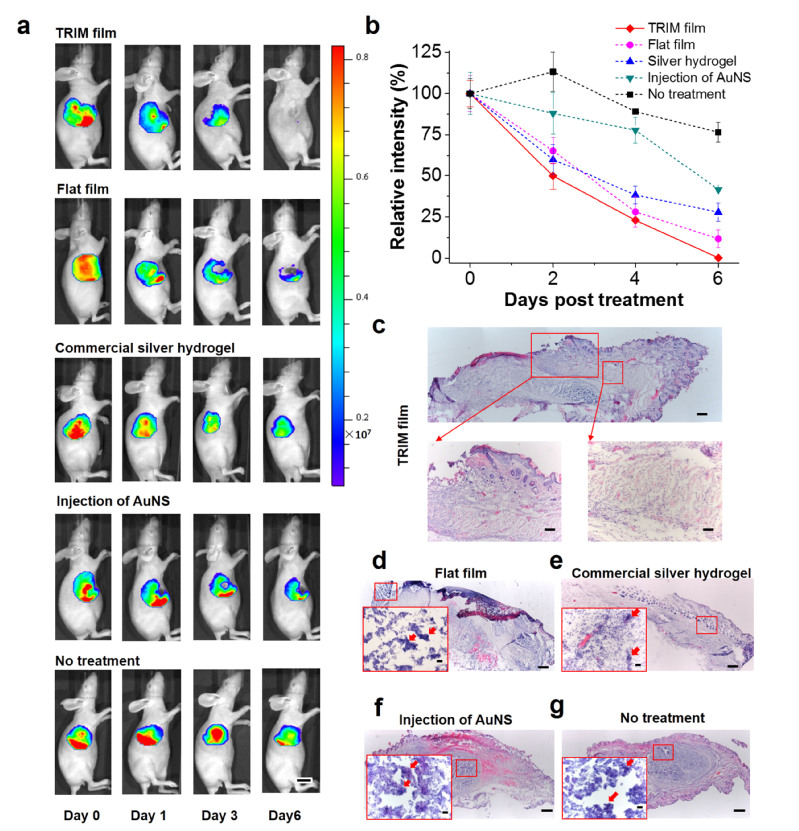
文中图5:对耐药菌感染的小鼠进行不同治疗策略的体内评估
本文第一署名单位是南京医科大学生物医学工程与信息学院,联合署名单位还包括南洋理工大学、美国斯坦福大学、美国西北大学、厦门大学、新加坡国立大学。
论文链接:
Benhui Hu,et al. Thermal‐Disrupting Interface Mitigates Intercellular Cohesion Loss for Accurate Topical Antibacterial Therapy, Adv. Mater., 2020.
DOI: 10.1002/adma.201907030
https://doi.org/10.1002/adma.201907030
